
乳腺癌是女性常见的恶性肿瘤之一,尽管目前乳腺癌总体的5年生存率已高达90%,但是IV期患者的五年生存率仅有27%。转移是乳腺癌患者死亡的主要原因,每年大约有50万患者死于转移性乳腺癌(mBC)。传统上mBC患者的治疗是根据HR和HER2的分型进行相关的内分泌治疗、HER2靶向治疗或者化疗。然而mBC患者在经历多线治疗后,没有标准的基于循证医学证据的后线治疗方式用于mBC患者。此外考虑到mBC的异质性和基因变异的动态变化,新的治疗策略是临床上亟需的。
循环肿瘤DNA(ctDNA)由肿瘤细胞死亡后释放到体循环中,理论上是来自不同转移部位的肿瘤DNA混合物,可以充分体现肿瘤的异质性。因此ctDNA可以作为mBC患者监测临床预后和治疗疗效的指标,并可根据ctDNA特定的变异指导mBC患者的后线治疗。
湖南省肿瘤医院乳腺内科欧阳取长主任团队与吉因加合作的一项研究成果Subtyping of metastatic breast cancer based on plasma circulating tumor DNA alterations: An observational, multicentre platform study发表在柳叶刀Lancet子刊eClinicalMedicine(IF=17.033)。该项研究采取吉因加1021基因Panel,对223例后线转移性乳腺癌患者治疗过程中的ctDNA进行高深度测序,探索了ctDNA指导后线转移性乳腺癌患者治疗的临床应用价值。相比没有ctDNA指导,ctDNA指导下的转移性乳腺癌患者的无疾病生存期(PFS)和疾病控制率显著提高。通过层次聚类的方法,根据ctDNA的突变基因,把后线转移性乳腺癌患者分为四种亚型:细胞外功能(ECF)、细胞增殖(CP)、核功能(NF)和级联信号通路(CSP)。在核功能和级联信号通路ctDNA突变的患者中观察到根据ctDNA突变指导治疗的显著临床获益。

研究设计
这是一项观察性、多中心研究,本研究于2016年12月至2019年6月共纳入223例拟接受后线治疗的转移性乳腺癌(mBC)患者。该实验将患者依据基线ctDNA的结果和是否具备相应的药物推荐,将患者分成ctDNA指导组(Druggrable ctDNA Alteration-Gudied Treatment, DDAT)和医师决策组(Physician-chosen Treatment, PCT)
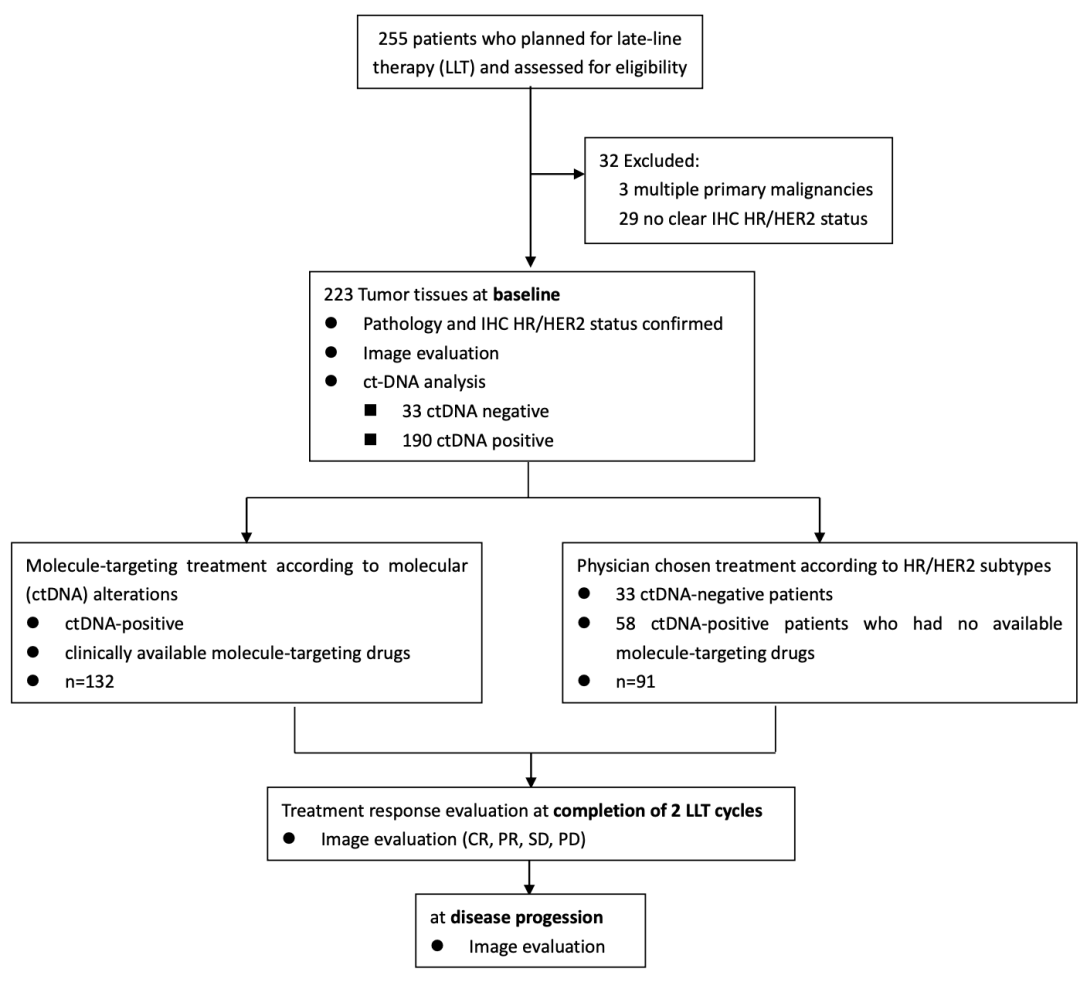
图1 分组临床设计方法
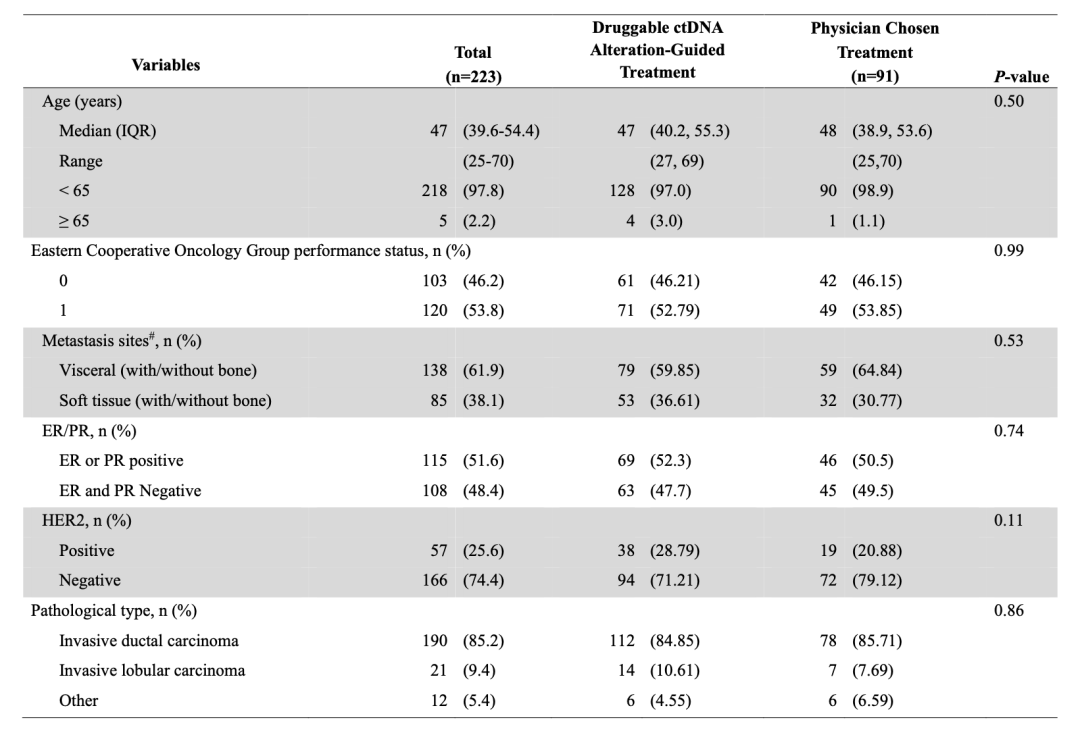
表1 入组人群的基本特征
研究结果
1.转移性乳腺癌ctDNA变异图谱
在参加该试验的223例患者中,190例患者(85%)在基线ctDNA被检出阳性,此外有132例患者(69.5%)检测到了可以提示临床靶向治疗的ctDNA 突变。研究结果显示,频繁突变的基因是TP53、PIK3CA、ERBB2、BRCA1、ESR1、CDK12和FGFR,除了TP53,其它基因变异均存在相关药物(图2)。
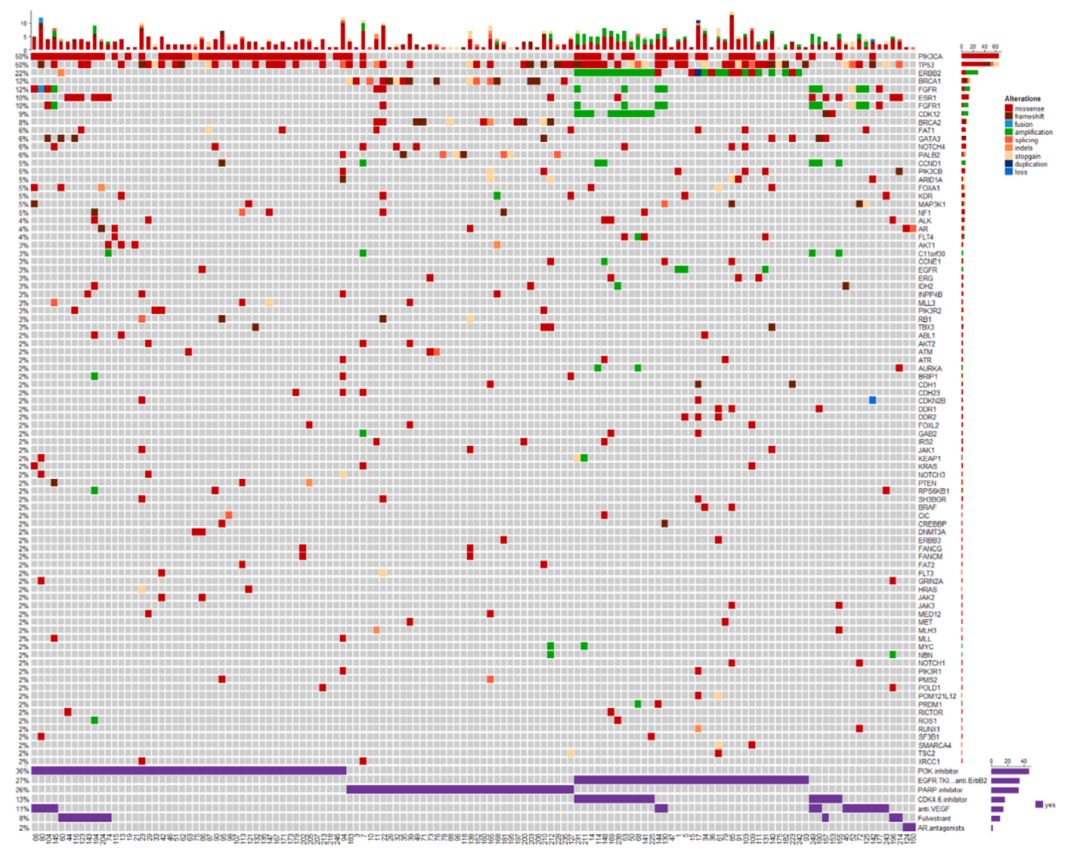
图2 ctDNA变化图谱
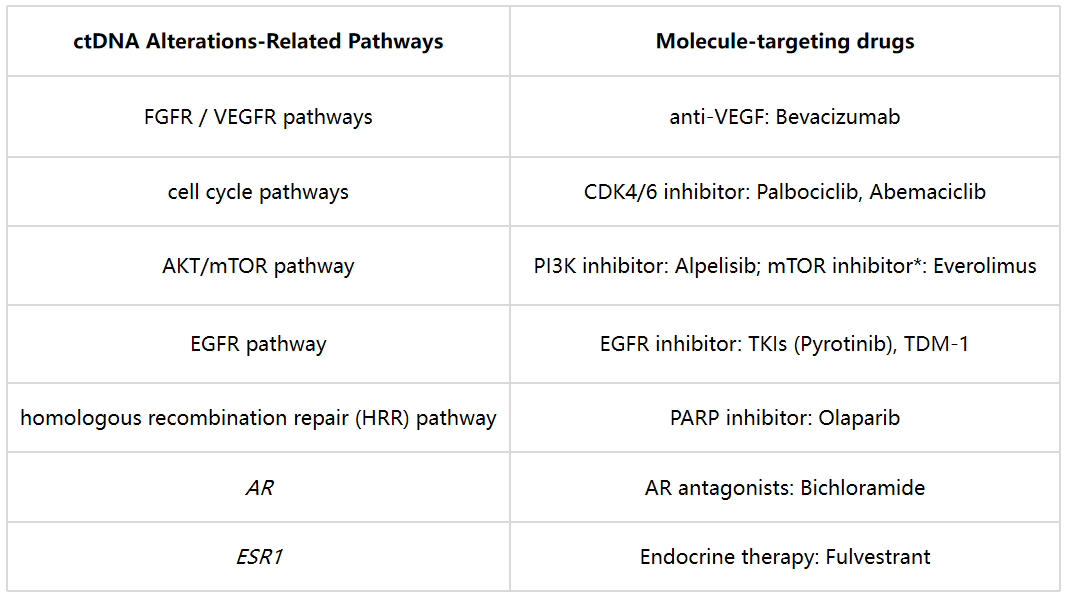
如下表所示(表2),具有FGFR/VEGFR突变的患者接受抗VEGFR/FGFR抑制剂单用或者联合化疗治疗,具有影响细胞增殖突变的患者使用细胞周期蛋白依赖性激酶4/6抑制剂(Cyclin-dependent kinase 4/6 inhibitor, CDK4/6i)治疗,具有同源重组修复( homologous recombination repair, HRR)通道突变的患者,接受PAPR抑制剂(PAPRi)治疗,具有PI3K/mTOR通路基因相关突变的患者接受PI3K/mTOR抑制剂治疗。总之,该研究发现绝大部分ctDNA阳性患者存在药物相关的基因变异,用于指导临床用药。
表2 不同突变类型的患者用药方案
2.DDAT组有更高的疾病控制率和无病进展生存期
经过两个治疗疗程后,通过影像学的方式对223例患者进行临床疗效评估(图3)。总体来说,45例患者疾病进展(PD), 92例患者疾病稳定(SD), 86例患者部分缓解(PR),疾病控制率(DCR)高达79.8%。在ctDNA指导治疗组(DDAT)中,89.4%的患者肿瘤PR或SD(118例),但是医师决策治疗组(PCT)中仅65.9%的患者PR或SD(60例),DDAT组有显著的临床获益(P<0.0001)。
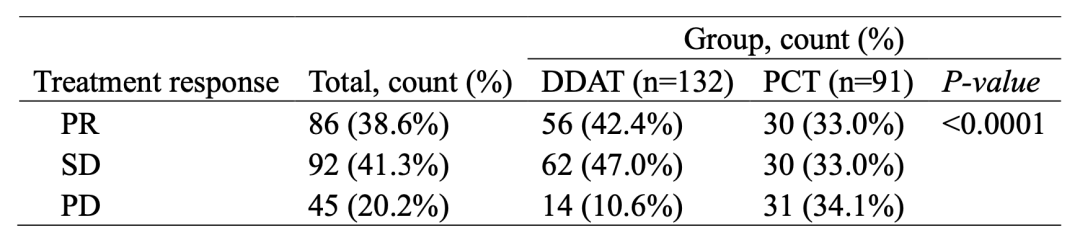
图3 223名患者临床疗效评估
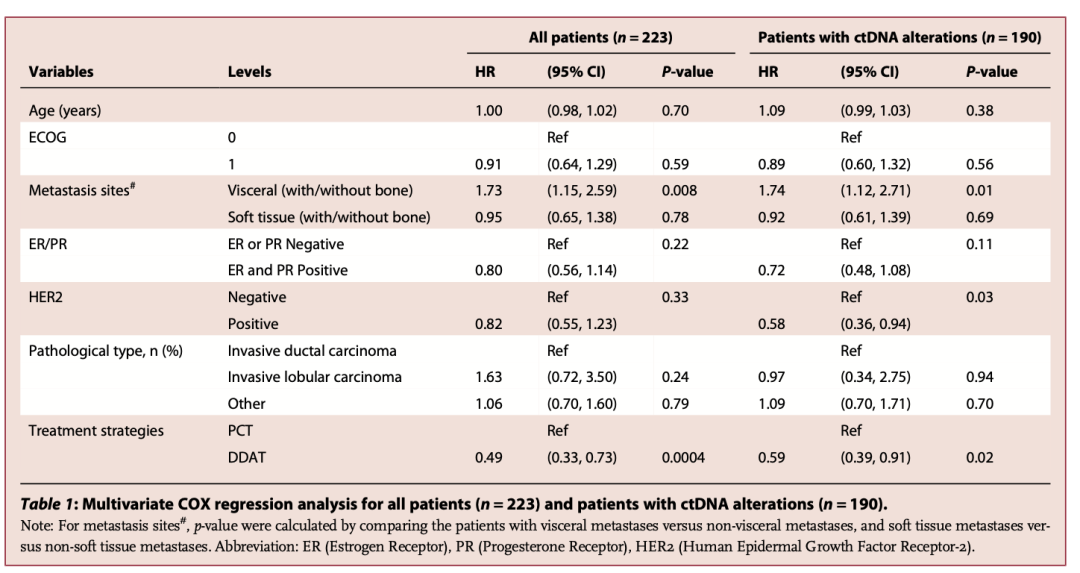
根据治疗策略进行亚组分析,生存曲线分析结果显示DDAT组的患者较于PCT组的患者具有更长PFS(6.3 vs 4.3 月,P<0.001)(图4),此外DDAT组的患者较于PCT组ctDNA阳性但是缺乏可用药物的患者同样具有更长PFS(6.3 vs 4.7月,HR: 0.56, 95%CI: 0.38-0.82, P=0.003)(图5)。COX分析结果也同样表明DDAT组的患者风险比显著低于所有PCT组的患者(HR:0.49, 95%CI: 0.33-0.73, P=0.0004)和PCT组ctDNA阳性但是缺乏可用药物的患者(HR:0.59, 95%CI: 0.39-0.91, P=0.02)(表3)。上述结果均表明利用ctDNA检测存在药物靶点的患者的临床获益有好于PCT组的患者。
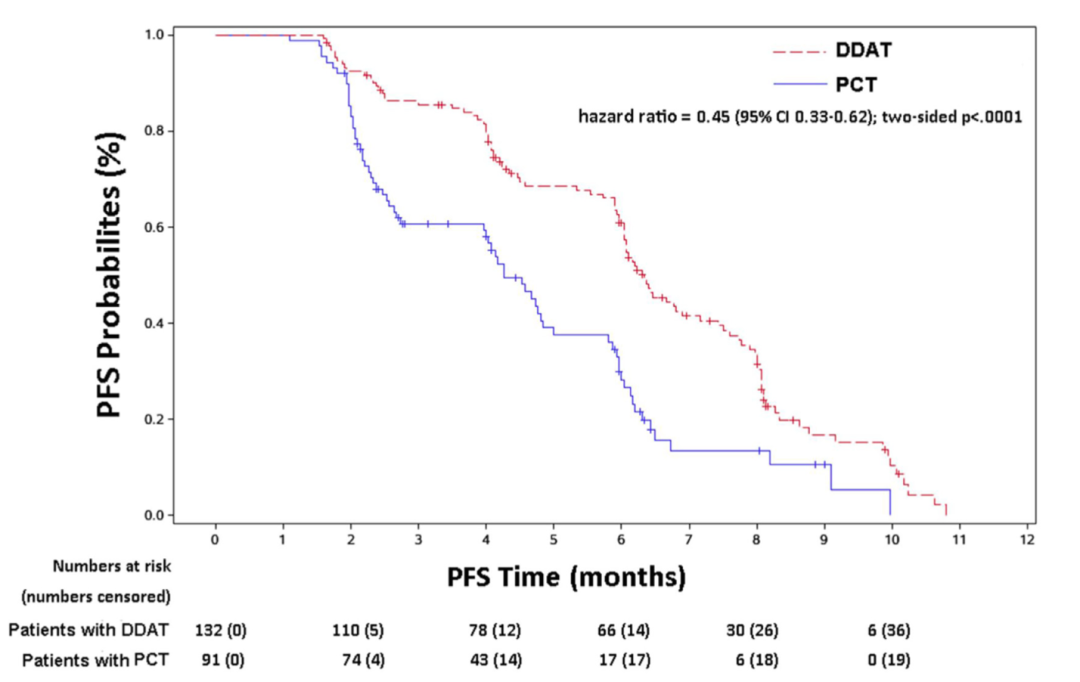
图4 DDAT组的患者较于PCT组的患者具有更长PFS
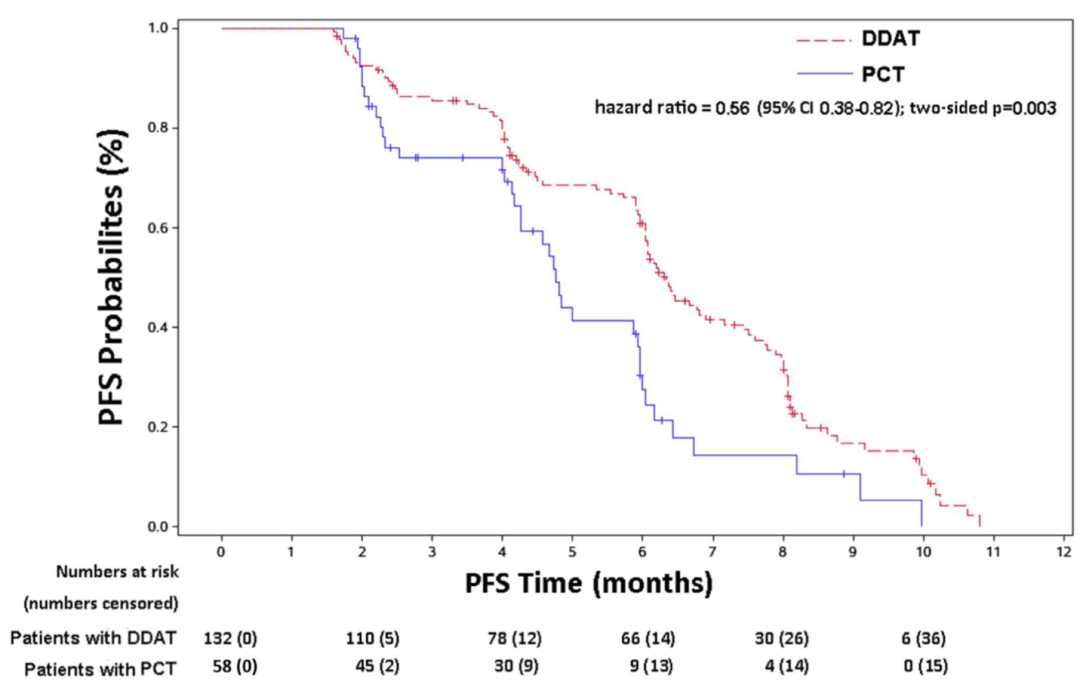
图5 DDAT组的患者较于PCT组ctDNA阳性但是缺乏可用药物的患者同样具有更长PFS
表3 所有患者(n=223)和ctDNA改变患者(n=190)的多元COX回归分析
3.不同分子亚型的转移性乳腺癌临床获益
该研究为了阐明不同的分子亚型对转移性乳腺癌临床获益的影响,利用层次聚类的方法将223例患者的ctDNA结果进行聚类。研究结果表明,转移性乳腺癌的基因变异可以分成4种亚型,分别是subtype 1(extracellular function,ECF同血管生成相关)subtype 2(cell proliferation, CP, 细胞增殖相关),subtype 3(nuclear function, NF, DNA修复相关)和 subtype 4(cascade signal pathway, CSP, PI3K/mTOR, MAPK等信号代谢通路相关)。为了评估不同的分子亚型对PFS临床获益的影响,本研究采用单因素COX分析的方法,其结果如下图所示, subtype 3亚型(NF)的患者相较于PCT的患者获得了显著获益(HR:0.394, 95% CI 0.238-0.652, P=0.0003),同时subtype 4亚型(CSP)的患者较于PCT患者获得了最好的临床获益(HR:0.142, 95% CI 0.094-0.215, P<0.0001)(图6)。然而,subtyple1(ECF)和 subtype 2(CP)亚型没有获得显著的临床获益(P>0.05)。这些结果表明DDAT组中特别是具有能够影响信号通路和DNA修复变异的患者能够获得更好的临床获益。
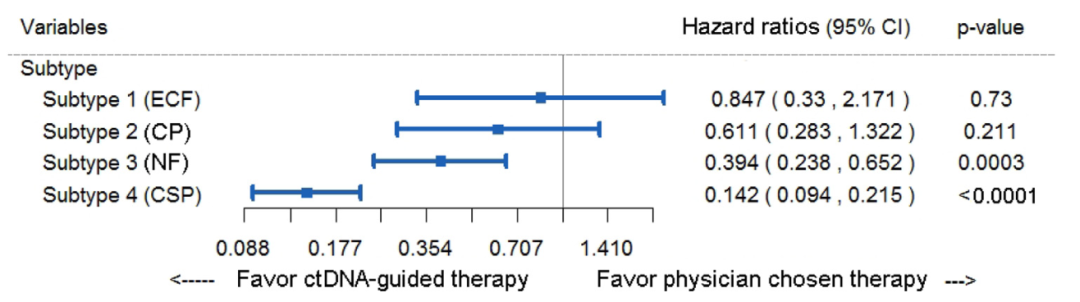
图6 基于ctDNA亚型的无进展生存风险比亚组分析
研究结论
总的来说,依据传统的HER2/HR的状态对乳腺癌患者进行分层进行治疗,但是经过多线治疗后,传统基于免疫组化的HER2/HR的状态不能指导转移性乳腺癌的患者治疗。该研究旨在强调ctDNA监测可以作为一种有用的技术手段提供全面的分子信息,指导后线转移性乳腺癌的药物治疗。利用转移性乳腺癌患者高频的突变基因对患者进行分子分型,从而选择不同治疗的策略,结果也表明这种方式相较于医师决策的系统临床获益更大。
吉因加致力于成为肿瘤临床科学家的首选合作伙伴 作为深耕肿瘤领域多年的精准医疗企业,吉因加十分重视技术和学术科研投入,成立初期就围绕肿瘤临床研究全面布局,组建了研究院、临床科研部及医学部,专注检测技术研发及肿瘤基础研究探索,聚焦新技术的临床应用及临床转化研究,从方案设计、项目执行、生信分析到文章撰写均有丰富的经验,在肿瘤基因组学、肿瘤进化与异质性、肿瘤免疫、肿瘤大数据等方面取得了丰硕成果,系列学术论文见刊于国际顶级期刊。 近年来,公司与国内外临床专家通力合作,累计发表SCI论文266篇(不包含被会议收录的论文),总影响因子(IF)达2501分,多项重磅文章问鼎Nature,Nature Medicine等顶级期刊封面。未来,吉因加将继续坚守学术研究的初心,期待和更多临床科学家合作,共同推动肿瘤个体化诊疗进程,为肿瘤防治事业贡献力量,让更多的临床患者获益。
参考文献:
1. Zhe-Yu Hu,Yu Tang,Liping Liu, et al. Subtyping of metastatic breast cancer based on plasma circulating tumor DNA alterations: An observational, multicentre platform study. EClinicalMedicine. 2022 Jul 17. doi: 10.1016/j.eclinm.2022.101567