
2019年12月31日,国家药品监督管理局批准苏州吉因加生物医学工程有限公司研发生产的“人EGFR/KRAS/ALK基因突变检测试剂盒(联合探针锚定聚合测序法)”通过三类医疗器械产品的注册审批。
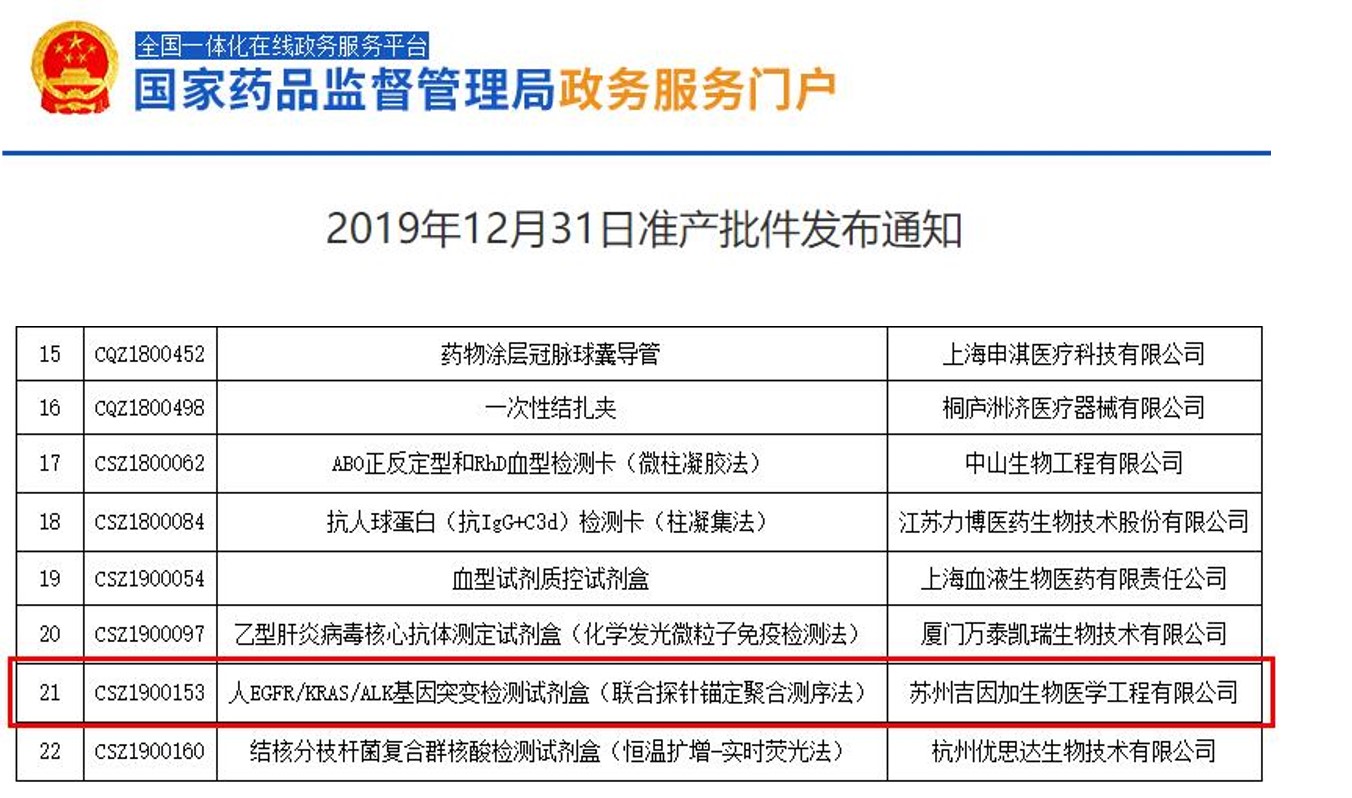
此外,该试剂盒还可同时检测BRAF、ROS1、MET、HER2、NRAS、PIK3CA、NTRK1等56个基因,不仅包括NCCN指南推荐的肺癌等的靶向治疗、耐药提示相关基因,还涵盖了肿瘤重要信号通路的上下游关键基因,可全面指导肺癌的靶向药物治疗,提高患者的临床获益率。

今年8月,Gene+Seq-200/2000国产基因测序仪获得NMPA三类医疗器械注册证,加之年初获批二类软件证书的Gene+OncoBox肿瘤NGS全自动分析解读一体机,吉因加在试剂、仪器和软件上一气呵成赢得“三证齐全”,印证了公司基于国产平台的肿瘤NGS全流程解决方案受到国家和临床层面的认可。接下来,吉因加临床合规、三证齐全的国产化高通量测序平台,将在全国各省市的三甲医院和肿瘤专科医院进行全面的推广部署和应用落地。
目前,北京吉因加医学检验实验室已完成国产基因测序仪Gene+Seq-2000的顺利转产,累计产出数据300T,数据质量优异;同时,Gene+Seq-200、Gene+Seq-2000和公司自主研发的OncoBox肿瘤高通量测序全自动分析解读一体机已进入北京协和医院、四川大学华西医院、中山大学附属肿瘤医院、河南省肿瘤医院、重庆市肿瘤医院等20多家全国重点医院,数据产出近100T,Gene+国产测序仪在临床应用上优势明显,广受好评。
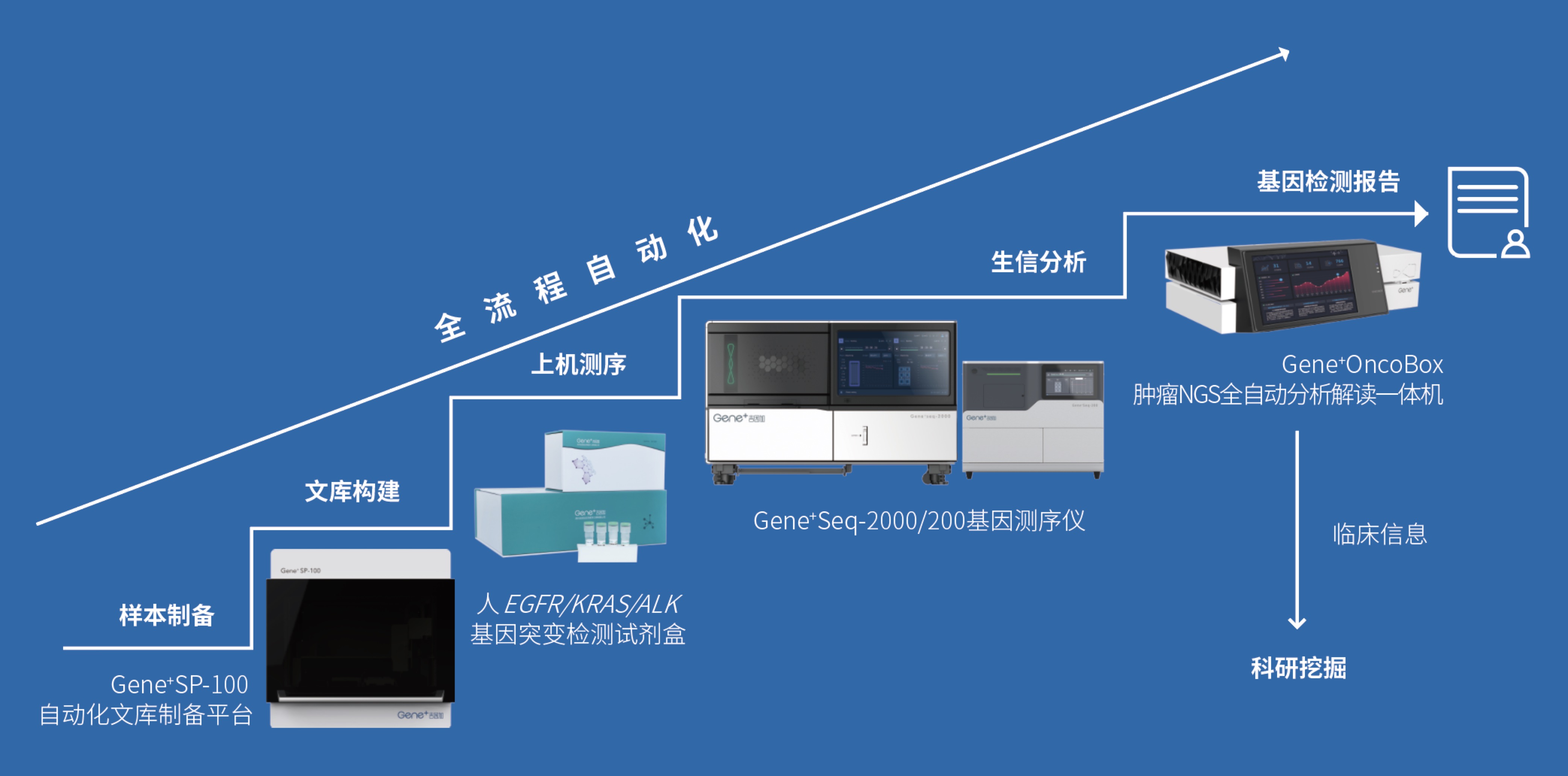
吉因加一直立足国产高通量测序平台战略,自2016年开始建设的苏州吉因加4000平米的医疗器械产业化基地,研发生产基因测序仪、试剂盒、自动文库制备平台等覆盖肿瘤NGS全流程的产品。基于已获证的试剂盒、测序仪和配套软件,同时配合轻松实现文库制备的Gene+SP-100自动化文库制备平台,可以为肿瘤NGS入院提供一体化解决方案,从而推动肿瘤精准医疗在临床应用上的普及和全面合规。