自2016年Science杂志将免疫治疗评为年度科学最大突破以来,PD-1/PD-L1抑制剂作为免疫治疗的代表性药物,为肿瘤治疗带来了许多突破性进展,部分肿瘤晚期患者因此延长寿命甚至实现临床治愈。然而,这个“抗癌神药”并没能完全代替其他传统药物。究其原因,是PD-1/PD-L1抑制剂存在一个缺陷,即PD-1/PD-L1抑制剂单药治疗仅对部分患者有效。
目前,提高PD-1/PD-L1抑制剂的有效率主要有两种手段。一是联合其他药物一起使用;二是通过生物标记物筛选合适的患者。月初,从ASCO2019盛会归来的吉因加团队给大家刚梳理完ctDNA液体活检领域的成果荟萃,今天我们则从免疫治疗出发,看看这一同样热门的领域又有哪些最新研究进展。
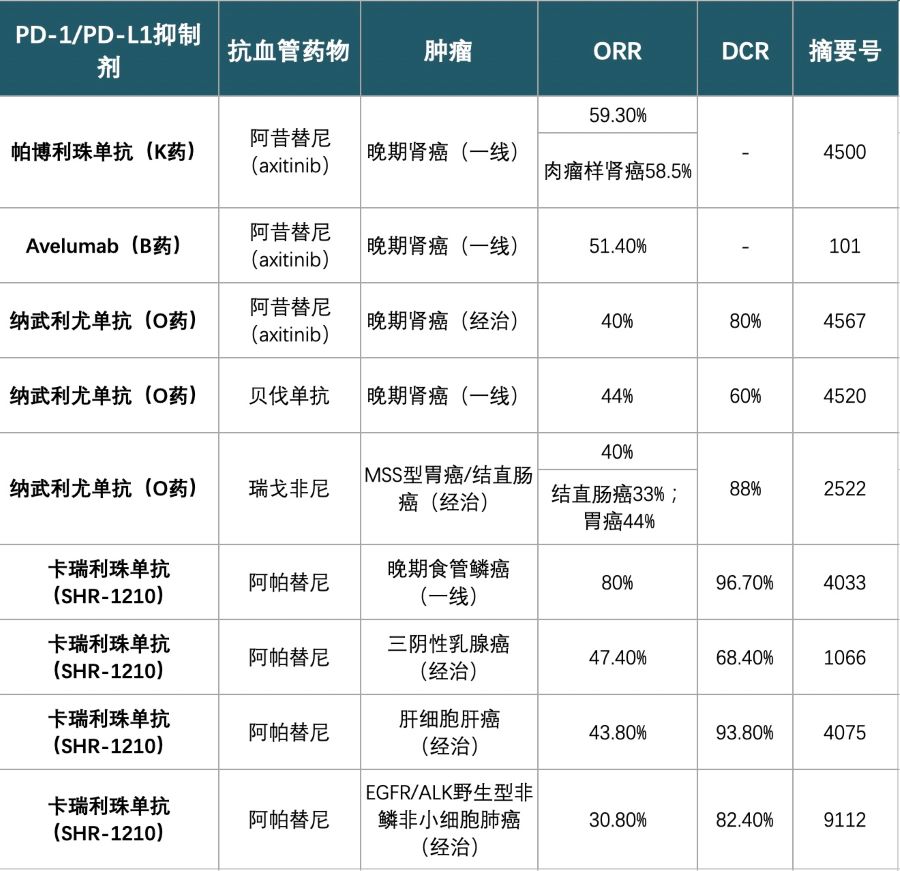
1. 免疫抑制剂联合抗血管药物:多个癌种展现神奇效果
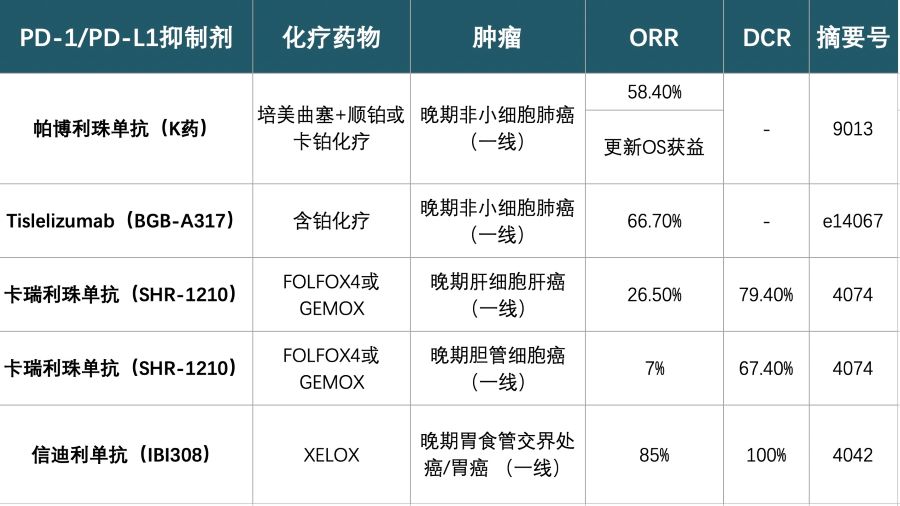
2.免疫抑制剂联合化疗药物:一线治疗效果突出
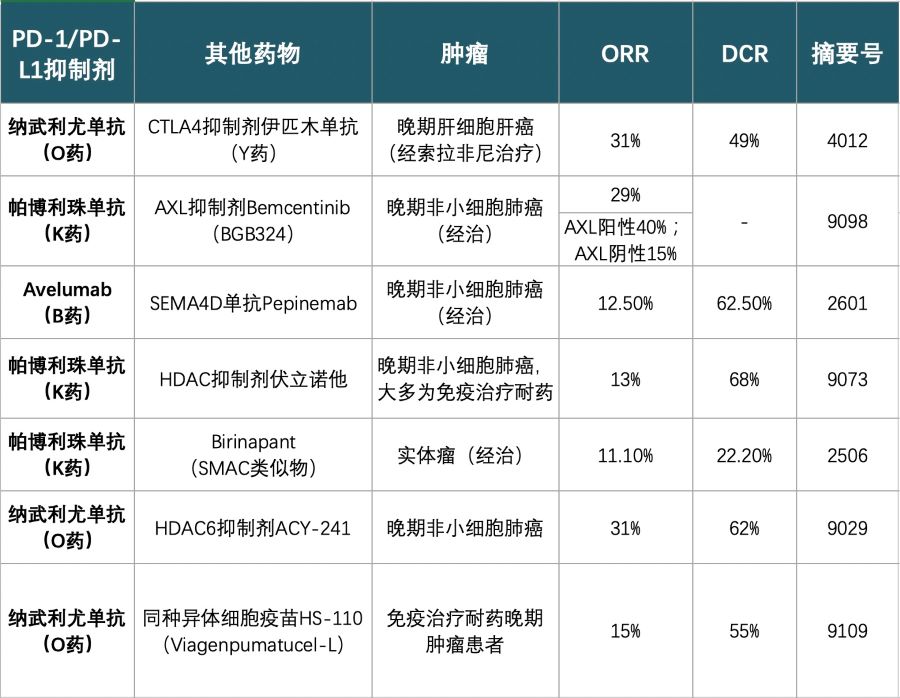
3. 免疫抑制剂联合其他药物:小荷才露尖尖角
免疫联合治疗使免疫治疗进入了全新时代,但有效患者比例仍有较大提升空间。因此,利用生物标记物寻找优势人群、提升用药患者疗效监测效能,仍是该领域的研究热点。
1.TMB&伴随突变
今年的ASCO会上,TMB和免疫治疗的疗效关联性在非小细胞肺癌中得到了进一步验证,而且PD-L1和TMB也被发现是疗效的两个相对独立的预测指标,两者联用预测效能最高(摘要号:2542)。
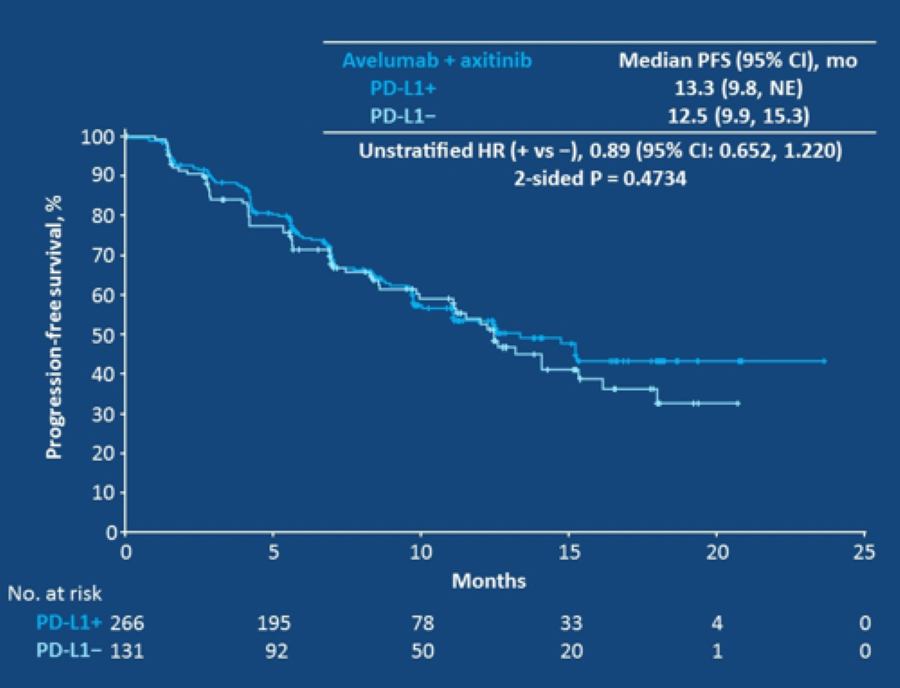
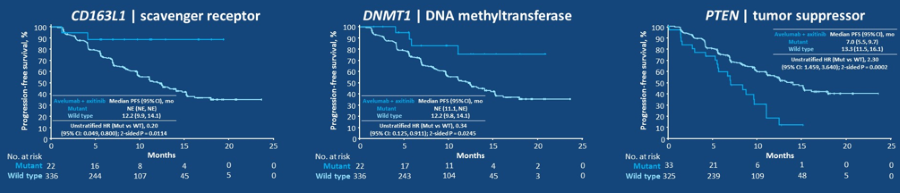
联合治疗中,生物标记物的探寻也仍在继续。卡瑞利珠单抗(SHR-1210)联合阿帕替尼(+-化疗)治疗晚期EGFR/ALK野生型非鳞非小细胞肺癌的研究中,发现血TMB高(>1.54Mb)的患者ORR高达52.6%,中位PFS7.8个月,而血TMB低(<1.54Mb)患者ORR则只有17.1%,中位PFS为5.6个月(摘要号:9112)。Avelumab(B药)联合阿昔替尼(axitinib)一线治疗晚期肾癌的研究发现,疗效与PD-L1表达与否无关,但却受治疗前基线状态的诸如CD163L、DNMT1、PTEN等基因的突变等的影响(摘要号:101)。
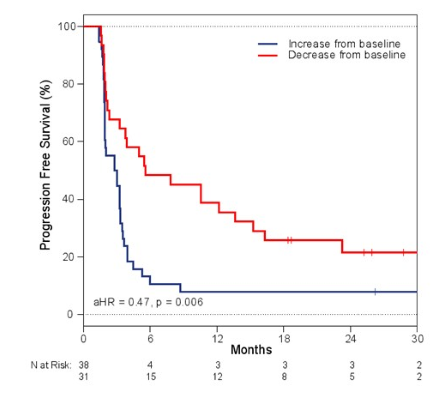
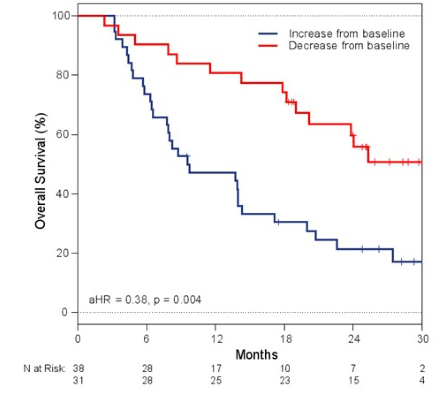
2.ctDNA动态变化与免疫治疗疗效在实体瘤和淋巴瘤中都得到证实
II期的INSPIRE 研究 (NCT02644369),纳入了70例包括头颈部鳞癌、三阴性乳腺癌、卵巢癌等多种实体瘤,患者接受帕博利珠单抗(K药)单药治疗,使用NGS测定患者治疗前基线期和治疗第3周期时的ctDNA,结果发现,ctDNA的变化(ΔctDNA)与OS、PFS、CBR和ORR与之间存在很强的相关性,提示这种潜在生物标志物可能在多个实体瘤中适用(摘要号:2542)。
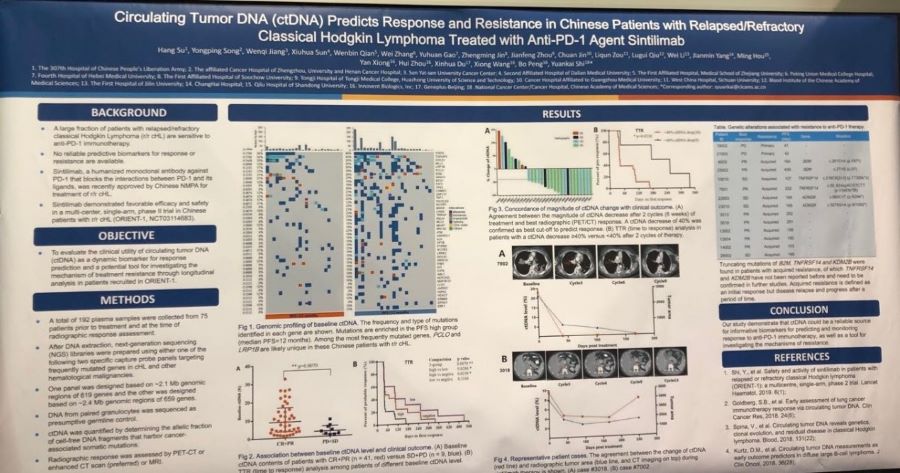
不仅如此,ctDNA对于免疫治疗疗效预测的价值在淋巴瘤中也得到了证实。我们对75名使用信迪利单抗的复发/难治性经典霍奇金淋巴瘤患者进行了ctDNA动态监测,在获得性耐药的患者中发现了B2M、DNMT3、TNFRSF14和KDM2B等已知或新的可疑耐药性突变。基线ctDNA水平在客观反应组和非反应组之间有显着差异。在三个治疗周期后,ctDNA下降40%可准确预测治疗获益,且这些患者的获益比其他患者更早(摘要号:7534)。
吉因加推出的晚期基线计划Plus,采用新一代高通量测序技术,检测并获取1021个肿瘤相关基因突变的定性、定量信息,全面分析肿瘤免疫治疗的相关指标。基于ctDNA动态监测和独创mTBI 分子肿瘤负荷指数,并结合影像学辅助免疫治疗的首次疗评,鉴别免疫治疗的假性进展,提前提示疗效变化,助力患者的个性化管理。