

编者按:肿瘤免疫微环境分析是研究肿瘤免疫逃逸机制的必由之路。大量研究表明,免疫反应具有二像性——同时接受正反馈和负反馈双重调节,为肿瘤细胞免疫逃逸留下可乘之机。肿瘤细胞仅需突破一个环节,就能破坏机体免疫平衡,调动细胞内外资源为其所用,营造适宜自身生长的微环境。那么肿瘤细胞是如何影响免疫微环境的呢?近日,吉因加联合重庆新桥医院、重庆西南医院及美国MD Anderson Cancer Center等多家国内外机构的研究成果发表在《Nature Communications》杂志上,团队针对15例非小细胞肺癌患者(NSCLC)的肿瘤免疫微环境进行深入分析,发现其具有空间异质性且受突变驱动,这为从基因层面进行肿瘤免疫治疗精准分型,发现免疫治疗新靶点提供了新路径。
文章题目:Local Mutational Diversity Drives Intratumoral Immune Heterogeneity in Non-Small Cell Lung Cancer
发表时间:2018.12.18
期刊名称:Nature Communications
影响因子:12.353
研究简介:
本研究共入组15例可手术非小细胞肺癌患者,其中肺腺癌患者(LUAD)11例、肺鳞癌患者(LUSC)3例、病理类型未确定患者(NOS)1例。经手术治疗后,取患者肿瘤标本,多组织部位取样,采集配对外周血,利用WES、RNA-seq、TCR-seq检测技术,全面分析TMB(非同义突变个数)和肿瘤免疫微环境。
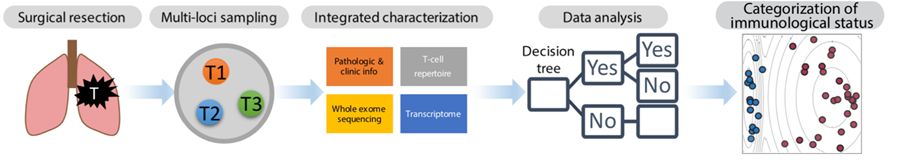
图1 采样策略及分析策略
一、发现肿瘤免疫微环境异质性
首先发现,不同的患者有不同的突变频谱,即使同一患者的不同组织部位中也存在一些非共有的基因变异和肿瘤新抗原。T细胞组库分析也发现,各组织中存在独有的高频T细胞克隆。进一步比较发现不同指标之间的相关性较弱,其中T细胞组库的多样性和TMB有弱的正相关(r=0.3448, **p=0.00861, Pearson correlation),暗示更高的肿瘤突变可能会驱动更多类型的T细胞浸润。但有趣的是,TMB和肿瘤局部的溶细胞杀伤作用无显著相关性(r=0.1845, p=0.3051, Pearson correlation)。
本研究依据文献报道,共综述出278种影响免疫微环境的变量,这包括TNB(新抗原负荷)、clonality(T细胞组库克隆性)、31个免疫调节基因、217个炎症通路和28种浸润免疫细胞亚群,利用机器学习算法,通过降维分析,发现肿瘤患者存在明显的空间异质性。来自12个患者的44个肿瘤标本可以被分成了16个“冷肿瘤”和28个“热肿瘤”,其中有6个患者的不同肿瘤部位同时存在“冷肿瘤”和“热肿瘤”。
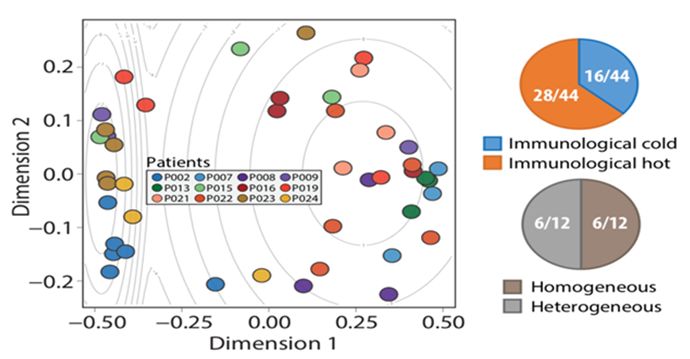
图2 瘤内免疫微环境具有异质性,
有一半的患者同时存在
“冷肿瘤”和“热肿瘤”的区域
有意思的是,和之前的研究报道类似,抗肿瘤免疫活性较强的区域内经常也有较多的免疫抑制细胞的浸润(r=0.8692, p<0.0001, Pearson correlation)。
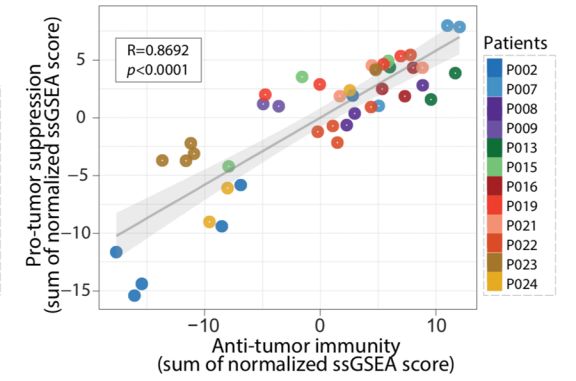
图3: 抗肿瘤免疫活性较强的区域内
经常也有较多的免疫抑制细胞的浸润
二、肿瘤突变异质性驱动免疫微环境异质性
进一步的进化分析发现,大部分患者(5/6)在不同的新抗原进化分支上,可能出现不同的免疫微环境状态,且进化距离越小,越有可能是相同的“冷/热肿瘤”状态,这也提示我们肿瘤新抗原的性质会影响抗肿瘤免疫状态。进一步提示我们肿瘤亚克隆中的突变会很大程度上影响肿瘤局部免疫表型,因此,对于肿瘤亚克隆变异的深入分析也会为肿瘤免疫微环境的预测,免疫治疗的疗效预测提供有效的生物标志物。
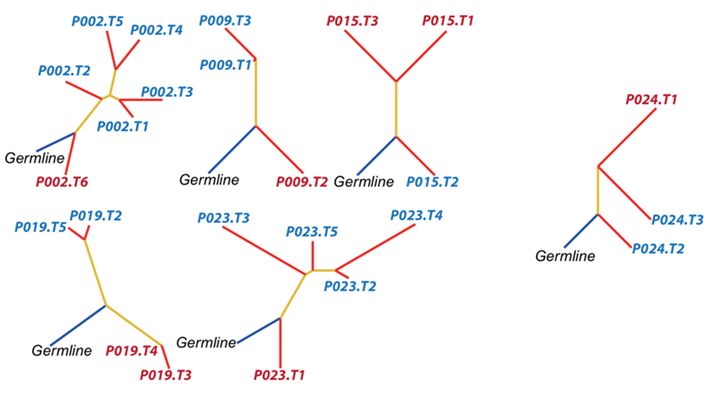
图4:不同进化分支中的亚克隆也存在不同的免疫微环境。红色标签代表“热肿瘤”,蓝色标签代表“冷肿瘤”
结语
本研究发现肿瘤免疫微环境存在较大的空间异质性,结果提示某些肿瘤的突变可以驱动瘤内免疫调节,结合免疫细胞浸润的空间异质性,可以引起不同的T细胞激活后的负反馈,这些最终决定了局部的免疫表型。也进一步提示我们要对单次组织取样的TMB和免疫微环境分析保持谨慎的态度。