

近日,北京协和医院乳腺外科周易冬教授团队与北京吉因加基因研究院的合作成果,在国际学术期刊Molecular Oncology(IF=5.264)线上发表。研究团队前瞻性入组71例原发性乳腺癌患者(primary breast cancer,PBC),采用吉因加ER-Seq低频纠错分析技术和1021-gene panel,首次分析了PBC患者中与循环肿瘤DNA(circulating tumor DNA,ctDNA)检测相关的临床因素。结果表明,组织活检和ctDNA检测的基因频率显著相关(R 2 = 0.9532,P <0.0001)。患者的N期状态(P < 0.001)和激素受体(hormone receptor, HR)状态(P = 0.001)可以独立预测血液中肿瘤来源突变的可检测性。
导读
目前,癌胚抗原(CEA)和癌抗原15-3(CA15-3)是乳腺癌临床常见的生物标记物。有研究表明,中国乳腺癌患者中CEA和CA5-3的敏感度仅为7.2%和12.3%。尽管组织活检是基因检测的金标准,但受限于取样偏差和瘤内异质性,无法动态监测肿瘤负荷的变化。因此,急需一种非侵入性、灵敏度高的肿瘤负荷实时监测生物标记物。
ctDNA源于肿瘤细胞的坏死、凋亡和分泌物,在血液中含量极低。已有研究表明,ctDNA能够进行乳腺癌患者的负荷检测和预后评估,但研究对象主要是多线治疗后或晚期转移患者,PBC患者的研究尚缺乏。另外,临床因素对ctDNA检测的影响仍然未知。
本研究入组71例PBC患者,进行组织活检和ctDNA检测,并分析其相关性。随后,评估了临床病理特征与ctDNA检测的相关性。最后,分析了ctDNA检测在主克隆、亚克隆、ERBB2扩增及相关临床actionable变异的检出情况。研究表明,大多数PBC患者可以检测到与肿瘤组织DNA一致的ctDNA片段,尤其是晚期患者和HR阳性患者。
研究简介
本次研究共入组71例PBC患者,收集其肿瘤组织和配对外周血样本,进行HER2免疫组化分析和高通量靶向测序,研究ctDNA检测用于PBC患者肿瘤负荷监测的可行性及其临床影响因素。
一、 入组患者特征
本次入组患者的诊断年龄和病理参数具有多样性,例如中位诊断年龄为47岁(范围27-78岁);超过一半的患者(53.52%)为TNM III期;I期,II期和IV期患者的比例分别为11.27%,25.35%和9.86%。52例(73.24%)患者为HR阳性,28例(39.44%)HER2过表达。
二、 组织活检和ctDNA检测一致性分析
70例(98.59%)患者肿瘤组织共检出226个SNV及Indel。ctDNA检测结果显示,48例患者(67.61%)共有114个SNV和Indel。组织和ctDNA的基因突变频谱见图1A。
为证实测序结果有效性,研究团队将组织活检和ctDNA检测结果与TCGA(n=1105)数据进行比对,结果发现它们的突变率非常相似(图1B)。另外,ctDNA突变中16个高频基因的突变频率和组织对应的突变频率显著相关(R2= 0.9235; P<0.0001;图1C),这表明ctDNA检测可以准确反映肿瘤组织的突变频率。
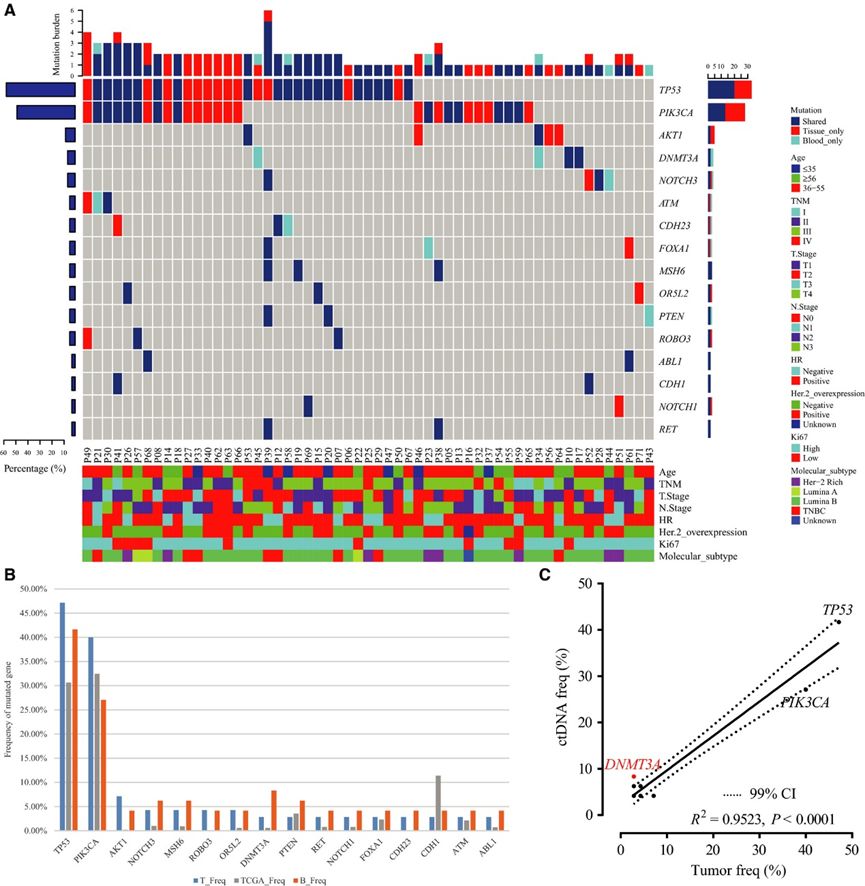
图1肿瘤DNA、ctDNA和公共数据库序列的基因组分析揭示了肿瘤DNA突变和ctDNA突变之间的强相关性
对ctDNA和组织突变检出进行GO和KEGG富集分析,发现组织特异性突变和重叠突变显著富集于“乳腺癌”通路(图2A、B),而血液特异性突变富集通路对乳腺癌不是典型通路(图2C)。其中,重叠突变子集富集的通路与药物耐药及敏感性相关。
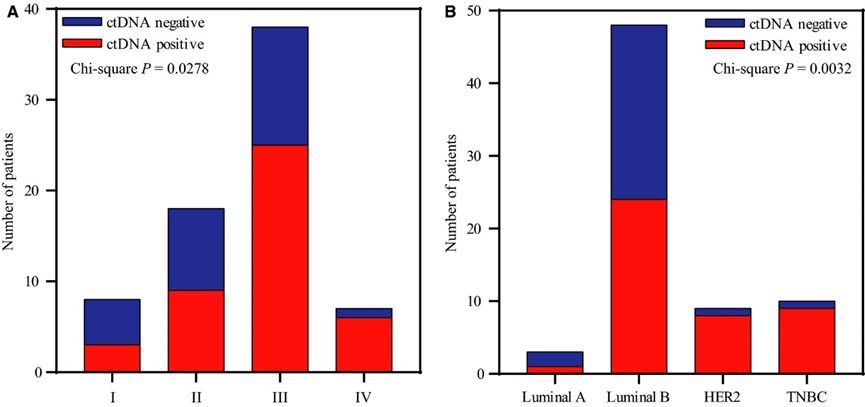
图2 KEGG分析组织特异性突变、重叠突变和血液特异性突变的生物学相关性
同时,ctDNA的突变等位基因频率(VAF)可表示分子肿瘤负荷,能够用于肿瘤监测。在评估了不同临床因素对ctDNA中MVAF的影响时,发现MVAF在转移患者(IV期 / M1期)中显著高于早期或局部晚期患者(I期至III期/ M0期,P=0.0136,图 4A)。MVAF在高T分期组中显著高于在低T分期组(P=0.0085,图 4B)。
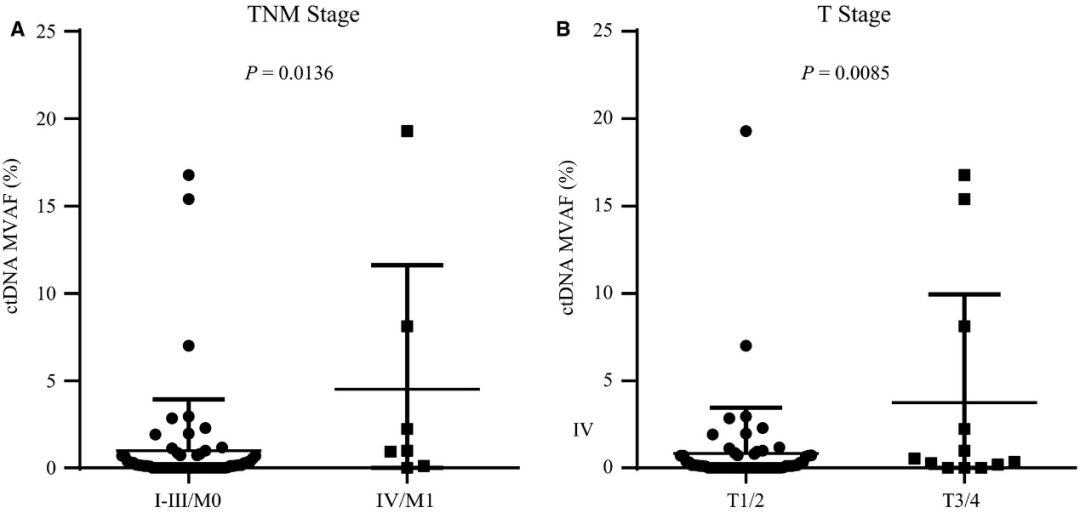
图 4 具有不同T分期和TNM分期的亚组间ctDNA MVAF比较分析
四、 肿瘤克隆对血液中肿瘤突变检测性能的影响
研究团队运用PyClone策略,分析了可从对应血液样本中检出肿瘤变异的43例组织样本的主克隆和亚克隆簇差异,同时比较这些主克隆和亚克隆在对照血中检出率的差异,发现主克隆和亚克隆突变分别在41名患者(93.35%)和20名患者(46.5%)的外周血检出(图5A)。高达84.62%的主克隆突变可以在配对血中检出,表明ctDNA检测能够捕获大部分肿瘤的主克隆突变。
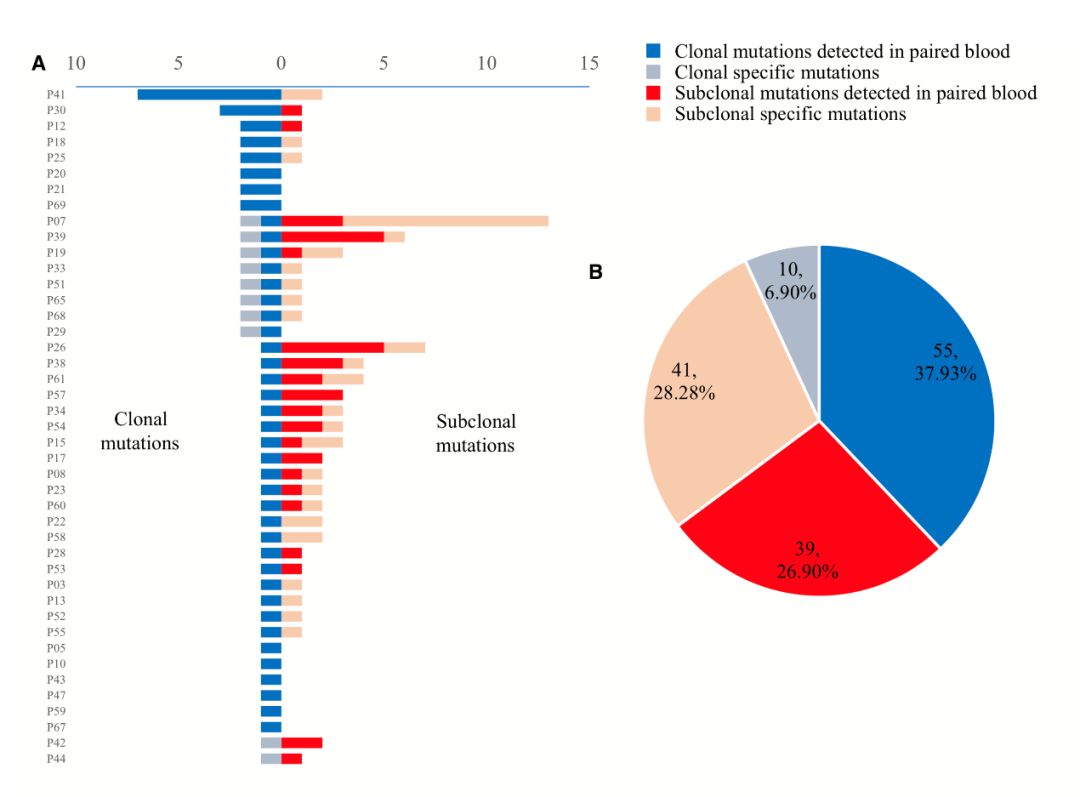
图5 ctDNA检测肿瘤主克隆及亚克隆分析
五、 组织活检和ctDNA检测在临床相关变异检出的一致性分析
HER2过表达主要由ERBB2扩增引起,其显著影响PBC患者的治疗选择。研究团队分析了HER2表达量与基于1021-panel检测的ERBB2扩增的相关性。28位HER2过表达患者中26位(92.86%)在肿瘤组织检出ERBB2扩增。ctDNA检测发现6例HER2过度表达的患者(21.43%)有ERBB2扩增,总体一致性为68.12%。尽管ctDNA检测的阳性预测值为100%,但是低阴性预测值(65.08%)限制了利用ctDNA进行CNV检测的临床应用(图 6C)。研究团队还评估了其他可行性突变。在19例ctDNA阳性患者中,16例(84.21%)在组织和血液中具有一致的actionable SNV(图 6D)。
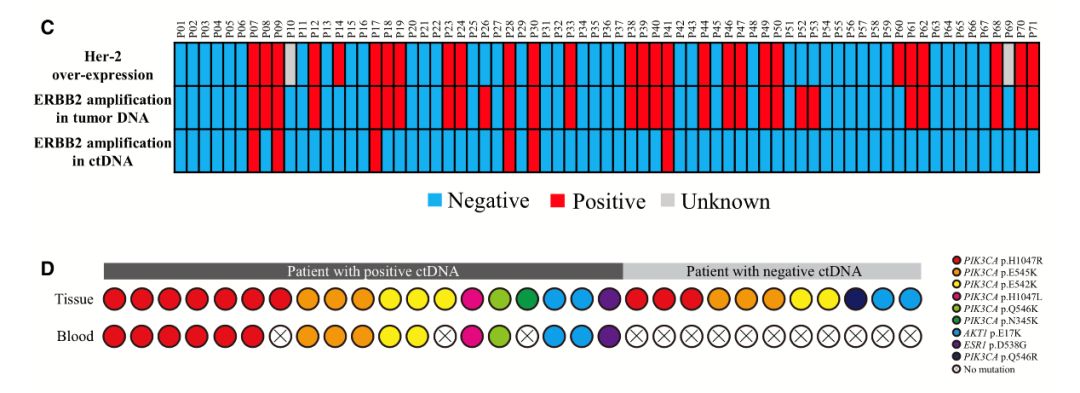
图6 ctDNA检测和组织DNA检测在临床相关变异的一致性比较
总结
研究表明,ctDNA检测能够用于大多数PBC患者,对来自肿瘤的功能性突变进行追踪,可以作为早晚期PBC患者临床诊疗的补充biomarker。一些临床因素也会影响ctDNA的可检测性,需要确定该方法适用的检测人群。然而,囿于研究人群规模较小、缺少基于ctDNA的临床管理实际案例等因素,研究结论仍需大队列研究和案例验证。目前,ctDNA检测突变频谱和组织活检结果的不一致性是ctDNA临床应用的最大障碍。血液中造血性非癌突变可以通过白细胞测序策略排除,但瘤内异质性和变异入血率问题仍客观存在,需要更多的努力来确定ctDNA检测的可靠性和临床价值。
ctDNA检测因其取材方便、相对无创、反复可用以及均质性等诸多优点,在术后评估、复发风险分层、疗效评估等领域具有重要临床价值。刚刚闭幕的第16届中国肺癌高峰论坛的专家共识中,已经将ctDNA在围手术期的检测纳入2B类推荐内容。吉因加自主开发ER-seq低频纠错分析技术,检出限达0.1%,饱和测序深度下可挑战至0.05%检出限,有效实现超高测序深度下血浆样本中低频突变的精准检出。目前,吉因加和合作伙伴利用ctDNA检测技术在肺癌、乳腺癌、结直肠癌等多个癌种进行临床研究,部分研究成果已在Nature Communications、Clinical Cancer Research、EBioMedicine、Molecular Cancer等国际学术期刊线上发表。